La dureté carbonatée dite limite (Hj) fait référence à la valeur critique à laquelle le CaCO₃ ne précipite pas dans des conditions et températures de qualité de l'eau spécifiques, où le CO₂ libre est soit absent, soit minime. Généralement, dans les systèmes d’eau de refroidissement, cette valeur varie de 2 à 4,5 mg équivalent/L. Cependant, en ajoutant des inhibiteurs d’acide et de tartre, un système d’eau de refroidissement peut maintenir des niveaux de dureté carbonatée plus élevés. Cet article explique la relation entre les inhibiteurs de tartre pour l’eau de refroidissement et la dureté limite du carbonate, fournissant des informations utiles aux professionnels du traitement de l’eau.
1. Ajout d'acide et limitation de la dureté du carbonate
En ajoutant de l'acide à l'eau d'appoint, la dureté carbonatée est convertie en dureté non carbonatée avec une solubilité plus élevée (telle que CaSO₄ et CaCl₂), ce qui réduit la dureté carbonatée de l'eau en circulation à un niveau inférieur à la dureté carbonatée limite, empêchant ainsi l'entartrage. Les réactions chimiques sont les suivantes :
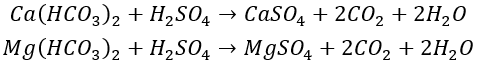
Continuer à partager une méthode de calcul de la quantité d’acide à ajouter en fonction de la dureté carbonatée et de la dureté carbonatée limite (Hj), comme indiqué dans la formule suivante.
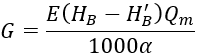
Dans la formule :
G est la quantité d’acide ajoutée, kg/h ;
E est la masse molaire de l'acide, pour l'acide sulfurique, E = 49, et pour l'acide chlorhydrique, E = 36,5 ;
Qm est le volume d'eau supplémentaire de l'eau de refroidissement en circulation, m³/h ;
α est la concentration de l'acide ;
HB est la dureté carbonatée de l’eau supplémentaire, mmol/L ;
H′B est la dureté carbonatée de l'eau supplémentaire après traitement acide, mmol/L.
H′B peut être calculé comme suit.
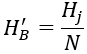
Dans la formule : N est le multiple de concentration ; Hj est la dureté carbonatée limite du système d'eau de refroidissement en circulation, en mmol/L.
La dureté limite carbonatée de l'eau en circulation après ajout d'acide, sans inhibiteur de tartre, peut être calculée à l'aide de la formule suivante :
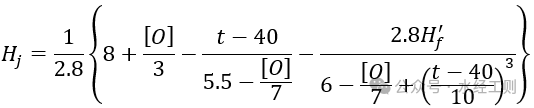
Dans la formule, [O] représente la consommation d'oxygène, en mg/L ; t représente la température de l'eau en circulation, en ℃.
Hf′ est la dureté sans carbonate après traitement avec un acide ajouté à l'eau supplémentaire, en mmol/L, et peut être calculée à l'aide de la formule suivante :
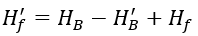
2. Utilisation d'inhibiteurs de tartre avec traitement acide pour limiter la dureté du carbonate
Lors de l'utilisation d'un traitement acide pour limiter la dureté carbonatée en association avec des inhibiteurs de tartre, le type d'inhibiteur de tartre utilisé doit déterminer la valeur Hj appropriée. Les inhibiteurs de tartre courants comprennent les polyphosphates, les phosphonates organiques (sels) et les acides polyacryliques.
Inhibiteurs du tartre polyphosphate
Les polyphosphates font principalement référence au polyphosphate de sodium, les formes couramment utilisées étant l'hexamétaphosphate de sodium (également connu sous le nom de polymétaphosphate de sodium) et le tripolyphosphate de sodium. Ces inhibiteurs dispersent et stabilisent les particules colloïdales et possèdent de fortes capacités de chélation des ions calcium et magnésium. Le polyphosphate de sodium fonctionne non seulement comme un inhibiteur de tartre, mais possède également des propriétés d’inhibition de la corrosion. Les propriétés spécifiques varient en fonction de la structure moléculaire de [NaPO₃] n , où la valeur de n détermine les caractéristiques. L'hexamétaphosphate de sodium a pour formule chimique [NaPO₃]₆ONa₂ et est un polymère de métaphosphate de sodium (NaPO₃). Lorsqu'il est utilisé comme inhibiteur de tartre, la dureté carbonatée limite Hj de l'eau en circulation peut être estimée par la formule suivante. La dose typique d’hexamétaphosphate de sodium varie de 1 à 5 mg/L, la limite supérieure étant utilisée pour les eaux à haute dureté carbonatée. Le tripolyphosphate de sodium (Na₅P₃O₁₀) a une forte capacité à chélater les ions calcium, avec un dosage typique de 2 à 5 mg/L et Hj = 5 mmol/L.
L’inconvénient des polyphosphates est leur tendance à se décomposer en orthophosphates dans l’eau, un processus connu sous le nom d’hydrolyse des polyphosphates. Le degré d’hydrolyse est influencé par des facteurs tels que le pH, la température, le temps et l’activité microbienne. L'hydrolyse est positivement corrélée à la température de l'eau et au temps de contact, bien qu'elle se produise à un rythme relativement lent, avec des taux d'hydrolyse typiques compris entre 11 % et 35 %.
Phosphonates organiques et leurs sels
Ces inhibiteurs de tartre sont efficaces et inhibent également la corrosion, ce qui en fait des inhibiteurs à double usage. Beaucoup de leurs propriétés sont similaires à celles des polyphosphates, mais ils sont plus stables et moins sujets à l’hydrolyse, même à des températures plus élevées. Cependant, les phosphonates organiques peuvent être corrosifs pour le cuivre et ne conviennent donc pas à une utilisation dans les systèmes d’échangeurs de chaleur en cuivre. Les phosphonates organiques courants et leurs sels utilisés au niveau national comprennent l'acide hydroxyéthylidène diphosphonique (HEDP), l'acide aminotriméthylène phosphonique (ATMP) et l'éthylènediaminetétra(acide méthylènephosphonique) (EDTMP). Lorsqu'ils sont utilisés conjointement avec des polyphosphates, ces inhibiteurs peuvent avoir un effet synergique, améliorant la dureté carbonatée limite de l'eau en circulation et réduisant le dosage de chaque agent. La dureté limite typique du carbonate pour ces inhibiteurs est la suivante :
HEDP : Hj = 8 mmol/L
ATMP : Hj = 9 mmol/L
EDTMP : Hj = 8 mmol/L
Polymères polycarboxylates
Les polymères polycarboxylates sont des polymères contenant des groupes fonctionnels carboxyles (groupes carboxyles) ou des dérivés d'acides carboxyliques. L'anion carboxylate (COO⁻) détermine les caractéristiques de ces polymères, où M représente un cation monovalent, un hydrogène ou un groupe amine. Après avoir été introduit dans l'eau, le groupe carboxylate se dissocie en COO⁻ et M⁺, le COO⁻ étant responsable de l'inhibition du tartre. Les inhibiteurs de tartre de polycarboxylate couramment utilisés au niveau national comprennent l'acide polyacrylique, le polyacrylate de sodium, le polyméthacrylate de méthyle, les copolymères d'acide acrylique et d'acrylate d'hydroxypropyle, les copolymères d'acide acrylique et d'acrylates et le poly(acide maléique) hydrolysé (anhydride). Les dosages typiques et les valeurs limites correspondantes de dureté carbonatée sont les suivants :
Acide polyacrylique : 1–9 mg/L, Hj = 5,5–10 mmol/L
Polyacrylate de sodium : 1–8 mg/L, Hj = 5,8–9 mmol/L
Poly(acide maléique) : 1–5 mg/L, Hj = 5–8,5 mmol/L
Résumé
En contrôlant la dureté limite du carbonate dans les systèmes d’eau de refroidissement en circulation, la formation de tartre peut être évitée. L'utilisation des méthodes ci-dessus pour calculer le dosage approprié d'acides et d'inhibiteurs de tartre, ainsi que la dureté limite admissible du carbonate du système dans des conditions de fonctionnement spécifiques, permet d'éviter les problèmes de tartre tout en réduisant les coûts chimiques.


